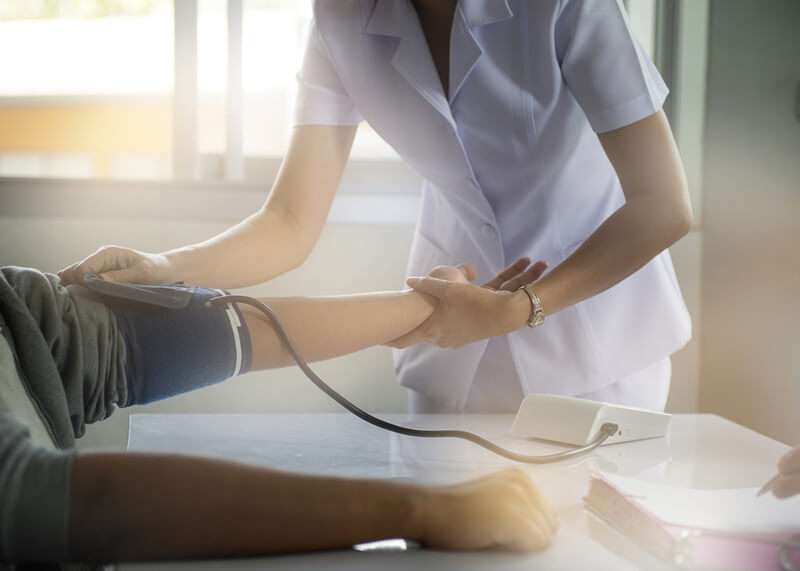
Hace ya varios meses que la industria farmacéutica y los centros de investigación, tanto públicos como privados, de distintos países, juegan una carrera en la búsqueda de vacunas, y/o drogas para la prevención y tratamiento del COVID-19.
Pocas veces se ha visto una reacción tan importante por parte de la industria y centros de investigación. En muchos casos, estos esfuerzos son llevados a cabo por distintos grupos de empresas e institutos de investigación, que aunaron esfuerzos y comparten, entre ellos, sus avances en la búsqueda de medios de prevención y tratamiento del COVID-19. Esos acuerdos se asientan en que cada participante ha adecuadamente protegido sus derechos sobre sus desarrollos, celebrando contratos de licencia voluntarios
La industria biotecnológica ha lanzado en los últimos cuatro meses más de 500 proyectos abocados a la búsqueda de vacunas y tratamientos. Varios de ellos, dirigidos a vacunas, ya están en la etapa de ensayos clínicos, alguno de los cuales ya han mostrado resultados positivos.
Haciendo una proyección histórica, se estima que sólo un 6% de las vacunas objeto de ensayos llegan al mercado. El gran desafío es lograr una vacuna que, además de ser segura y eficaz, esté en condiciones de ser fabricada y distribuida lo más rápido posible. Esto es, tan pronto reciba la aprobación de las autoridades regulatorias.
En cuanto a posibles tratamientos, han habido ensayos de productos conocidos para otras patologías, como los que utilizaron ciertos antivirales como la combinación de lopinavir y ritonavir (utilizado para el tratamiento del HIV), remdisivir (un antiviral de amplio espectro utilizado en el tratamiento del Ébola), azitromicina en combinación con la hidroxicloroquina, el ifenprodil (tratamiento de la fibrosis pulmonar), la dexametasona (un corticoide con propiedades antiinflamatorias, inmunosupresoras y antialérgicas), el plasma de enfermos recuperados o el suero hiperinmune, por mencionar alguno de los recursos que se han explorado en estos últimos meses. Si bien en algunos casos hay indicios sobre ciertos efectos positivos, lo cierto que en todos los casos los resultados son parciales. Hasta el día de hoy, no hay un tratamiento suficientemente efectivo.
Por lo que respecta a resultados de estudios en curso, solo algunos de ellos son concluyentes. Por ejemplo, el estudio llevado a cabo con dexametasona, que indica que su uso en el tratamiento del COVID-19, en pacientes graves conectados a respiradores, puede reducir las muertes a 1/3(1). Para concluir que existen beneficios reales en el uso de esta droga, se hizo un estudio randomizado que, por el volumen del ensayo, implicó una inversión significativa cuyo éxito, en un principio, no estaba asegurado.
Como ocurre con cualquier medicamento, tanto para la prevención como el tratamiento de este virus, los costos de investigación y ensayos clínicos son elevados. A la vez, todos están sometidos al riesgo de que, llegada la última etapa, como el éxito no está asegurado, los resultados no sean los esperados. Agreguemos a eso, el tiempo que insume tanto la investigación, como los ensayos clínicos y un adecuado sistema de distribución. Desde que se comienza a investigar una molécula, hasta que el producto llega a la farmacia, usualmente, pasan no menos de 10 años.
En el caso del COVID-19 los esfuerzos apuntan a achicar esos tiempos. Para eso, en muchos casos se comenzó investigando nuevos usos de medicamentos conocidos, lo que comúnmente se llaman en general “segundos usos”.
Investigar, realizar ensayos clínicos y luego fabricar, sea una vacuna o un producto para tratar determinada enfermedad, requiere inversiones millonarias por parte de los laboratorios que, para llevar adelante esos procesos, deben disponer de los fondos necesarios. En muchos casos los centros de investigación, tanto públicos como privados, reciben aportes de diversos orígenes para financiar los proyectos.
Los resultados de la investigación son protegidos en la inmensa mayoría de los casos a través del sistema de patentes de invención. Éste asegura al inventor que, durante un plazo limitado de tiempo, gozará de un derecho exclusivo que le permitirá, no solo cubrir los gastos incurridos en esa labor de I+D, sino generar fondos para encarar futuros desarrollos. Para esto, es necesario que exista un marco legal adecuado que reconozca el esfuerzo de los inventores. Como veremos más adelante, lamentablemente esto no ocurre en la Argentina.
Tal es la importancia de las patentes como aporte a la labor de investigación de empresas y centros de investigación, que la Organización Mundial de la Propiedad Intelectual puso a disposición de quienes se encuentran abocados a la investigación de vacunas o tratamientos, para el COVID-19, más de ochenta millones de documentos consistentes en patentes, y otros documentos relacionados con las mismas.
La posibilidad de libre uso de ésta documentación, accesibles en diez idiomas, permitirá a los investigadores tener a su disposición información de inmenso valor como lo es aquella contenida en un documento de patente. Esto nos muestra la importancia que un adecuado sistema de patentes tiene, no solo como un incentivo a la investigación y la obtención de una retribución por el esfuerzo de llevarla adelante, sino también, para hacer posible que terceros tomen como base los conocimientos existentes en las investigaciones que han encarado o planean encarar.
¿Las patentes de invención son una barrera en el acceso de las medicinas?
Frente a la pandemia de COVID-19, han surgido voces en nuestro país y en el extranjero, que consideran que la existencia de derechos exclusivos - en cabeza de quienes han investigados distintas alternativas preventivas y terapéuticas- constituye una barrera que limitará el acceso de la población a estos tratamientos o medicamentos.
También se ha hecho mención al contenido de la legislación en general – tratados internacionales y legislación local – que, a través de un régimen de licencias compulsivas, contemplan herramientas que harían posible que estos productos puedan llegar al mercado a través de terceros.
Respecto a las alegaciones que afirman que los derechos de propiedad industrial constituyen un obstáculo en el acceso a las nuevas medicinas, cabe señalar que las trabas responden , en realidad, a otras múltiples causas. El saliente Director General de la Organización Mundial de la Propiedad Intelectual (OMPI), Francis Gurry, señaló que en lo que se refiere al sistema de patentes, los tratados internacionales contienen provisiones que permiten superar los posibles obstáculos para el acceso al mercado de los medicamentos y terapias en cuestión.
Otros obstáculos pueden darse en: políticas públicas deficientes o tardíamente adoptadas en materia de acceso a medicamentos, demoras en el sector regulatorio (que debe aprobar el inicio de ensayos clínicos exigidos por las normas regulatorias), el control de los ensayos clínicos, la aprobación misma de los productos, las normas aplicables a la importación de medicamentos o sus componentes, y demoras en la distribución por mencionar solo algunos.
En lo que se refiere al sistema de patentes como instrumento para incentivar la investigación, la relación costo/beneficio ha demostrado ser positiva. A punto tal, que la inmensa mayoría de los países cuentan con legislación que reconoce el derecho del inventor y lo protege.
Existen, y han existido en el pasado, propuestas que tenían al Estado como protagonista. Este régimen contempla que sea el Estado (o sea, los contribuyentes) quien asume el riesgo al encarar el desarrollo de un producto, por ejemplo, una vacuna, que luego no mostrara la necesaria eficacia y seguridad para ser aprobado y llegar al mercado. En el sistema de patentes, en cambio, el riesgo lo corre exclusivamente quien encara una investigación y desarrollo de un nuevo producto.
Hoy vemos como diversos actores han encarado la investigación de medicinas para la prevención y el tratamiento del COVID-19. Se han formado alianzas estratégicas, en las que se comparte información y se comprometen inversiones importantes, todo ello en aras de desarrollar productos que permitan capear esta pandemia. Esas alianzas contemplan cual será el derecho que cada parte tendrá sobre el fruto de las investigaciones encaradas.
No cabe duda de que los resultados de esas investigaciones podrán ser protegidos a través del sistema de patentes o, incluso en ciertos casos, a través del régimen de los secretos industriales. Más adelante, haremos referencia a las iniciativas dirigidas a establecer un sistema de aportes a un centro de información tecnológica como el establecido a finales del mes de mayo de 2020 por la Organización Mundial de la Salud. Iniciativas, que difícilmente sean acompañadas por quienes han invertido tiempo y fondos, en desarrollar nuevos y efectivos productos para luchar contra el COVID-19 quienes, sin embargo, han manifestado su predisposición para poner sus productos y desarrollos a disposición del sistema de salud a costos razonables, algunos, incluso en forma gratuita.
Corresponde señalar, que la dificultad que enfrentan los inventores para proteger ciertas invenciones a través del sistema de patentes conduce a que, al no existir el incentivo de la exclusividad por un cierto lapso, luego no se investigue y desarrolle con la rapidez que las circunstancias pueden exigir. En muchos casos, las trabas impuestas por el sistema a los inventores los llevan a optar por mantener en secreto los elementos claves de la invención. La consecuencia, es que los terceros se ven impedidos de acceder a los conocimientos que proporcionan los documentos de patentes, cosa que en definitiva, termina perjudicando a toda la comunidad científica.
Las licencias obligatorias y el uso público no comercial
Ni bien se dieron a conocer los esfuerzos dirigidos a encontrar un remedio o tratamiento adecuado para la prevención y/o tratamiento del COVID-19, distintas voces -escudadas en el objetivo loable de lograr el acceso de los medicamentos para la mayor cantidad de personas- propusieron iniciativas dirigidas a conformar una suerte de “pool de conocimiento” en el cual, las empresas que están investigando, aporten los resultados de sus investigaciones; secuencias genéticas, datos sobre el resultado de los ensayos clínicos, patentes, etc. Diferente es el caso del llamado Medicine Patent Pool (MPP), una organización apoyada por las Naciones Unidas a través de la cual empresas innovadoras como AbbVie, Bristol Myers Squibb, Gilead, Merck Sharp Dohme las que ponen sus patentes a disposición de terceros a través de licencias no exclusivas
La propuesta que se da en el marco de la Organización Mundial de la Salud, tuvo el apoyo de una veintena de países, entre ellos Argentina. Sin embargo, hasta el momento y al menos en la etapa de lanzamiento, no tuvo el apoyo de países como Estados Unidos, Alemania, Suiza, China o India.
Detrás de este tipo de iniciativas hay intenciones desprovistas de intereses sectoriales, pero también, hay quienes, desde una posición ideologizada, buscan erosionar el sistema de patentes u obtener alguna ventaja comercial. No hay que olvidar, que hay fuertes intereses económicos de sectores que buscan su propio rédito a expensas de quienes arriesgan e invierten en I+D.
En líneas generales, se puede decir que, quienes hasta ahora sostienen que las patentes constituyen una barrera en el acceso a los medicamentos o desempolvan de las legislaciones las normas sobre licencias obligatorias, no se ocupan – a la vez - de contribuir con propuestas o proyectos para apoyar la generación de nuevas medicinas.
Sin duda, todos los esfuerzos dirigidos a posibilitar el acceso de nuevas medicinas e innovación médica a la mayor cantidad de personas resultan loables. Sin embargo, no es culpando a las patentes y como consecuencia de ello debilitando el derecho de quien invirtió tiempo y dinero en investigar, como se logrará hacer accesibles los medicamentos a todos. De lo contrario, la consecuencia será una demora en las posibilidades de acceso a los nuevos tratamientos. Si se dan abusos en algún eslabón de la cadena, existen recursos legales para hacerlos cesar.
En determinadas circunstancias, el régimen de licencias obligatorias puede resultar un recurso de gran utilidad para la lucha contra una pandemia. Sin embargo, hay que reconocer que el sistema en sí no ha tenido una aplicación práctica muy extendida. Son pocos los países en los que se han concedido estas licencias, llamadas también “no voluntarias”, y donde ésto ha ocurrido, el presupuesto básico para su otorgamiento fue la existencia efectiva de patentes concedidas. La escasa utilización de las licencias obligatorias, es una clara señal de que ese instituto no ha tenido el desarrollo que sus inspiradores pensaron iba a tener.
El régimen de licencias obligatorias, fue inicialmente adoptado por nuestro país con la sanción en el año 1966 de la Ley 17.011 que adhirió a la Convención de París para la Protección de la Propiedad Industrial.
Casi 30 años más tarde, se volvió a legislar sobre el tema. Primero con la sanción de la Ley 24.425, que a finales del año 1994 aprobó el Acta Final de la Ronda Uruguay de Negociaciones Económicas Multilaterales, cuyo Anexo 1C incluye el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio (ADPIC), y luego, meses más tarde, al adoptar una nueva Ley de Patentes a través del dictado de la Ley 24.481.
El sistema entonces, está vigente en nuestro país desde hace más de cincuenta años, y sin embargo, a la fecha no se otorgó una sola licencia obligatoria. Queda claro que, aún cuando el sistema existe, su aplicación práctica es nula.
Más recientemente, el 21 de diciembre de 2019, el Congreso Nacional sancionó la Ley de Solidaridad Social y Reactivación Productiva N° 27.541. El artículo 70 de esta ley, faculta al Ministerio de Salud a establecer alternativas de “licencias compulsivas u obligatorias”, en el caso de que posibles problemas de disponibilidad, o alzas injustificadas o irrazonables de precios, afecten el acceso de la población a medicamentos o insumos del sector salud.
Es poco probable que en nuestro país y en el campo farmacéutico se pueda llegar a otorgar una licencia de esa naturaleza.
¿Cuál es el marco legal actual, en Argentina, para la protección de invenciones en el área farmacéutica?
El marco legal vigente en nuestro país no excluye la patentabilidad de los desarrollos en el campo farmacéutico, sin embargo, en la práctica la mayor parte de ellos no son protegibles.
En materia de protección de invenciones, el marco legal supranacional, dado por el Tratado ADPIC (Ley 24.425), prohíbe discriminar según el tipo de tecnología. La propia Ley de Patentes no contiene norma alguna que sirva de fundamento para excluir a las invenciones en el campo farmacéutico. Sin embargo, a través de sendas resoluciones -claramente inconstitucionales- dictadas en el año 2012, la mayor parte de los desarrollos en el sector industrial mencionado no pueden ser protegidos por patentes.
El 2 de mayo de 2012 a través de sendas “Resoluciones Conjuntas”, los Ministerios de Industria (Res. 118/2012), de Salud (Res. 546/2012) y el Instituto Nacional de la Propiedad Industrial (Res. 107/2012), bajo el título de “Pautas para el Examen de Patentabilidad de las Solicitudes de Patentes sobre Invenciones Químico-farmacéuticas”, establecieron que no se considerarán como patentables una serie de invenciones que hasta ese momento eran protegibles.
En otras palabras, mediante simples resoluciones ministeriales, se establecieron graves limitaciones a un derecho de rango constitucional ello sin que se haya producido un cambio en la legislación de fondo. Así, a través de esas “Resoluciones Conjuntas”, se excluyó de protección a composiciones y formulaciones farmacéuticas (incluidas las vacunas para humanos), las nuevas aplicaciones de compuestos ya conocidos, polimorfos y otros derivados de compuestos (con algunas excepciones). En consecuencia, a menos que se trate, por ejemplo, de nuevas moléculas, la inmensa mayoría de los desarrollos que se han encarado para prevenir y tratar el COVID-19 no podrán ser protegidos en nuestro país.
De cara a éste panorama, vigente desde 2012, llama la atención que el Ministerio de Salud - que bien sabe de la existencia de las Resoluciones Conjuntas- no haya advertido la escasa o nula aplicación que tendrían las licencias obligatorias previstas en el mencionado art. 70 de la Ley 27.541. Asimismo, sorprende que haya pasado por alto que la legislación vigente – Convenio de París, ADPIC y Ley de Patentes – ya contenían las herramientas suficientes que permitían recurrir a licencias obligatorias en situaciones como la actual pandemia.
Lo llamativo de la norma mencionada, es que la misma parte de la premisa de que existen, o existirán, patentes que amparen productos farmacéuticos del tipo de las composiciones farmacéuticas, vacunas, nuevas aplicaciones de productos ya usados para otras patologías, etc.
Sin duda, que existan patentes que amparen lo que hasta el 2012 era patentable (composiciones farmacéuticas, nuevos usos, etc.) sería en el mejor interés de la salud pública. Dado que las licencias obligatorias se conceden en forma no exclusiva, el licenciatario competiría con el titular de la patente y esto conduciría a una baja en el precio de los productos.
Si se piensa en las licencias obligatorias como solución para superar problemas de precio o de abastecimiento, ese instrumento requiere como requisito fundamental la existencia de patentes que se habrán de someter a ese régimen de excepción. Sin patentes no puede haber licencias obligatorias. Vimos como con el actual marco legal, pensar en que existan patentes sobre las cuales aplicarles el régimen de licencia sin el consentimiento del titular es algo casi imposible.
Para favorecer el desarrollo y la investigación a nivel local, lo que puede redituar en enormes beneficios para la salud pública y la población en general, es preciso derogar las inconstitucionales Resoluciones Conjuntas y establecer mecanismos que permitan un trámite de patentamiento más rápido, tal y como han hecho otros países.
También es necesario prever mecanismos más ágiles en el proceso de ensayos clínicos, área en la que nuestro país se ha destacado como líder dentro de la región. En este sentido, los protocolos de investigación clínica farmacológica generados por la industria farmacéutica local y extranjera en los últimos años, y aprobados posteriormente por la ANMAT, representaron una inversión superior a 1250 millones de dólares.
En un momento en el que, especialmente las vacunas, ya están ingresando en la fase correspondiente a los ensayos clínicos, estos estudios deberían continuar. Esto será posible, en la medida en que exista seguridad en el nivel de protección que se otorgue a los productos que se someten a ensayos. El marco legal vigente hoy en nuestro país esta lejos de asegurar un nivel de protección razonable. A ello debemos agregar la necesidad de que los datos de prueba obtenidos tengan un nivel efectivo de protección.
Por otro lado, suponiendo que lo que se pretenda proteger fuera patentable bajo las estrictas, e incomprensibles, exclusiones de las Resoluciones Conjuntas, y siempre que las correspondientes solicitudes se presenten en el curso de este año 2020, en caso de que la patente se conceda ello ocurrirá dentro de no menos de cinco años, momento en el cual es de esperar que no existan situaciones que justifiquen tener que recurrir a licencias compulsivas.
Algunas conclusiones
De lo expuesto, surge como primera conclusión que, con relación a los productos farmacéuticos, el régimen de licencias obligatorias establecido por diversas normas vigentes en nuestro país es de escasa o nula aplicación. En particular en lo que se refiere a la prevención y tratamiento de COVID-19. Ésto es así, no solo porque el sistema vigente prohíbe el patentamiento de la mayor parte de las innovaciones en ese sector industrial, sino porque, aun cuando lo permitiera, difícilmente se concedería una patente en los próximos 12 meses que pudiera ser objeto de una licencia obligatoria.
Es preciso reconocer el derecho del inventor sin demoras, y sin exigencias que desalienten la inversión. Muchos de los desarrollos a los que hoy se les niega protección, logran reconocimiento legal en la mayoría de los países de América Latina. No podemos ignorar que el sistema internacional de patentes, a través de los tratados asi como normas de nuestro derecho interno tienen dentro de sí las herramientas necesarias para impedir cualquier abuso. A lo largo de la experiencia recogida durante muchos años, ha demostrado ser el más eficaz para promover la investigación y desarrollo, tanto de la industria farmacéutica como de los demás sectores a tal punto que, aún aquellos países que por razones ideológicas lo habían resistido, finalmente lo han adoptado.
Un comentario final: de no haber existido personas que hayan desarrollado sistemas como Zoom o Meet, difícilmente se hubiera podido lograr un desarrollo fluido del teletrabajo, sin olvidar otras herramientas desarrolladas a lo largo de los años que hoy permiten trabajar a distancia en forma virtual. Y es a través de los mecanismos de protección que establecen las leyes de propiedad intelectual que se logró que todos nos acomodáramos a una nueva realidad que jamás pensamos que íbamos a vivir tanto en lo personal como en lo laboral.
Citas
(1) Ver https://www.nature.com/articles/d41586-020-01824-5
Artículos
Beccar Varela


opinión
ver todosJuztina AI
Kabas & Martorell
Barreiro